![]() L’intérêt
de la prévision en microbiologie alimentaire :
L’intérêt
de la prévision en microbiologie alimentaire :
La microbiologie prévisionnelle est une discipline qui
vise à développer des modèles mathématiques permettant de prévoir les
aptitudes de croissance, survie ou décroissance des populations microbiennes
dans les aliments en fonction des facteurs environnementaux influents.
La sécurité et la qualité des aliments sont de
plus en plus assurées par l’utilisation d’une démarche HACCP (Hazard
Analysis Critical Control Points) qui cherche à maîtriser systématiquement
l’incidence microbiologique de tout ce qui dans la fabrication peut contribuer
à la contamination, à la destruction ou à la multiplication des contaminants.
Cette démarche est facilitée si l’on est capable de modéliser le
devenir des microorganismes. Cette méthode permet donc de répondre aux
questions suivantes :
-
comment concevoir et fabriquer un produit offrant toute sécurité ?
-
comment modifier la composition d’un produit pour éviter un développement
microbien indésirable sans nuire aux qualités organoleptiques ?
-
Quel niveau de contamination, quel facteur de multiplication peut on tolérer
aux différents points de la chaîne ?
Cette prévision
est basée sur un modèle, c'est-à-dire un système établissant une
correspondance entre un ensemble de conditions et une cinétique d’évolution
de la population microbienne significative.
La microbiologie prévisionnelle
permet de construire une courbe de croissance microbienne qui dépend d‘un
ensemble de facteurs. On pourrait penser qu’il est possible de relier
directement l’intensité de ces facteurs à la courbe. Cependant, c’est
difficile car la courbe dépend de paramètres caractéristiques qui dépendent
eux-même de facteurs différents selon des lois différentes. On préfère donc
exprimer ces paramètres en fonction de leurs facteurs déterminants.
On en distingue trois principaux :
-
Le temps de latence λ qui dépend de l’état initial des
microorganismes et des caractéristiques de leur environnement.
-
Le taux de croissance exponentielle μ qui dépend essentiellement
des caractéristiques de l’environnement.
-
Le maximum A relié à la concentration [L] du facteur limitant grâce au
rendement f selon la relation A=k[L]
La connaissance
de ces trois paramètres grâce aux différentes valeurs des facteurs du milieu
permet de tracer la courbe.
Dans certains
cas, on trouve une troisième possibilité qui consiste à exprimer directement
le temps au bout duquel sera atteint le seuil d’effet (pour un inoculum donné),
c'est-à-dire le temps nécessaire pour la multiplication par un
facteur déterminé (1000 par exemple).
1 – Identification des paramètres limitant de la conservation du
produit :
Puisqu’on cherche à déterminer une date limite de consommation (DLC),
il faut déterminer ce qui limite la durée de conservation de cette sécurité
et/ou cette qualité.
Il faut donc répondre aux questions suivantes :
-
Quel est ou quels sont les microorganismes qui limitent cette durée ?
-
Quels sont les niveaux à ne pas dépasser ?
Par exemple, il
ne faut pas dépasser 100 listérias par gramme d’aliment à la DLC.
2 – Délimitation du champ de l’expérimentation
Elle procède en trois étapes :
-
sélection des facteurs à prendre en compte grâce à des données
bibliographiques. On trouve notamment la température, le pH, l’activité de
l’eau (aw), la présence d’inhibiteurs…
-
la détermination pour chaque facteur de la gamme des valeurs permettant
la multiplication. Par exemple, pour Listeria monocytogenes, la croissance est
possible entre 1 et 42°C.
-
la délimitation de l’étendue de variation possible dans les produits
alimentaires. Plus le champ expérimental sera étroit et plus le modèle sera
précis.
3 –
Planification de l’expérimentation :
Pour chaque facteur, il faut par exemple décider du nombre de niveaux à
tester , de la distribution de ces niveaux (progression arithmétique ou géométrique),
du choix des combinaisons de facteurs (plans expérimentaux), des répétitions
éventuelles.
4 – Recueil des données :
Pour chaque ensemble de conditions retenues, on inocule un milieu de culture ajusté à ces conditions et on mesure l’évolution de la concentration microbienne en fonction du temps de façon à tracer une courbe de croissance.
A – Le milieu de base :
L’idéal serait de prendre l’aliment considéré comme milieu de
base. Cependant, la texture de l’aliment est en général peu adaptée à ce
type d’expérience. On utilise donc des broyats ou des extraits liquides.
Mais dans certains cas, ces extraits demeurent impropres à l’expérimentation :
on s’oriente alors vers des milieux semi synthétiques riches.
B – L’inoculum :
L’inoculum sera constitué de l’espèce microbienne considérée.
En général, on ne réalise pas de cocktail de souches mais plutôt
plusieurs expérimentations mettant en œuvre des souches différentes. De plus, on choisit des microorganismes en pleine activité ou au
moins aussi actif que dans l’aliment considéré.
Enfin, la concentration microbienne à inoculer dépend de la méthode
utilisée pour suivre la croissance.
C – La méthode de mesure :
Le dénombrement classique sur milieu gélosé est encore très courant.
Cependant, cette technique se révèle longue et fastidieuse.
Deux méthodes automatiques se développent actuellement : la
turbidimétrie et l’impédancemétrie. Cependant, elles présentent deux
inconvénients importants :
-
elles imposent des contraintes lourdes au choix du milieu (transparence,
composition ionique).
-
Ce ne sont pas des méthodes de dénombrement :elles mesurent un
paramètre de culture ayant un lien avec la concentration microbienne.
5
– Modélisation :
Il s’agit, à partir des données expérimentales, de construire un
modèle établissant un lien entre condition expérimentale et croissance de façon
à permettre la prévision. Le modèle doit pouvoir être défini par un nombre
limité de paramètres, de préférence λ, μ et éventuellement A.
La façon la plus simple de le faire consiste à revenir aux définitions
habituellement admises de λ,
μ et de déterminer ces paramètres par la méthode graphique ou par des
calculs statistiques (droite de régression).
Courbe de croissance d’une culture microbienne
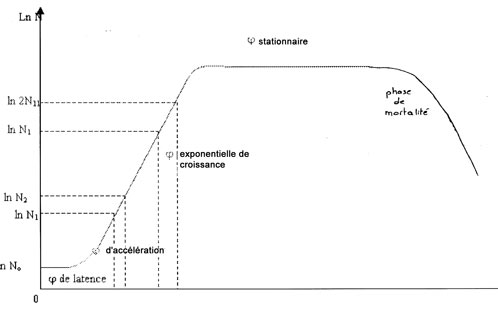
On utilise actuellement deux types de modèle pour décrire une cinétique
de croissance
dans des conditions données :
-
le modèle de Gompertz modifié : c’est un modèle purement
empirique, qui ajuste en général les données de croissance observées de manière
satisfaisante. Cependant, il présente un certain nombre d’inconvénients
(surestimation du taux de croissance, l’ajustement ne peut être réalisé que
si la cinétique de croissance est suivie jusqu’à la phase stationnaire…).
-
Le modèle de Barany, qui ajuste très bien les données de croissance généralement
observées, est un peu moins empirique. De plus, il ne présente pas les inconvénients
du modèle précédent.
6
– La validation :
Elle se réalise
à deux niveaux :
-
la validation mathématique qui consiste à vérifier que les écarts
entre les valeurs théoriques prévues par le modèle et des données obtenues
dans les conditions qui ont servi à le construire ne sont pas excessifs.
-
La validation dans des produits qui consiste à vérifier que les écarts
entre les valeurs théoriques prévues par le modèle construit à partir des
données obtenues en conditions expérimentales et les valeurs réelles obtenues
sur des produits industriels contaminés naturellement ne sont pas excessifs.
7
– Prévision :
Si le modèle a
été validé, il peut être utilisé pour la prévision, à condition de se
limiter, pour ce qui concerne la variation des facteurs, à la gamme des valeurs
comprises entre les valeurs qui ont fait l’objet de la validation. Il faut éviter
l’extrapolation ou être conscient des risques qu’on prend en la pratiquant.
L’extrapolation est impossible à cause du caractère empirique des modèles
construits.
![]() Applications,
limites et perspectives
Applications,
limites et perspectives
1 – Les applications
Cette approche permet de concevoir un système de production minimisant
les risques par des voies plus raffinées qu’un traitement thermique brutal ou
un aditif à dose massive. C’est un outil précieux qui permet de se
rapprocher d’un idéal consistant en ce que la qualité et la sécurité du
produit soient garanties par sa conception même.
Comme nous l’avons déjà dit, cette modélisation permet également de
déterminer une DLC raisonnable ou encore d’adapter le processus et la formule
à la DLC souhaitée. Il est ainsi possible de déterminer une DLC lors de la
conception du produit et de la préciser par la suite grâce à des données réelles.
De plus, cette modélisation est précieuse lors de la mise en œuvre de
la démarche HACCP, outil essentiel de l’assurance qualité. La microbiologie
prévisionnelle intervient à différentes étapes de cette méthode :
-
analyse des étapes du processus de fabrication et localisation des
points critiques.
-
Choix des critères à appliquer
à ces points critiques et des limites ou tolérances à leur affecter.
-
Détermination à l’avance des actions correctives à appliquer n cas
de défaillances : nouveau traitement thermique, destruction…
-
Vérification et documentation. Ainsi, la modélisation peut permettre de
monter à un inspecteur que le produit est sûr.
Cependant, les
avantages que nous avons décrit précédemment ne sont pas encore tous
pleinement réalisables. Il existe encore des limitations.
2
– Les limitations actuelles :
On reproche
souvent à la microbiologie prévisionnelle un caractère pessimiste. En effet,
on considère qu’un modèle est valide s’il ne sous estime pas le risque.
Mais le plus souvent, les valeurs observées sont très inférieures aux prévisions.
Ainsi, les durées de conservation prédites sont très inférieures aux durées
de conservation réelles, ce qui est pénalisant pour les fabricants.
Cet écart est du
au fait que l’on utilise des systèmes simplifiés, qui ne tiennent pas compte
de certains attributs caractéristiques des aliments pouvant freiner la
croissance microbienne :
-
l’effet structure qui limite les transferts de matière
-
les phénomènes de compétition entre la flore banale et les pathogènes
dont on cherche à modéliser la croissance.
-
La variabilité intersouches
-
L’histoire antérieure des microorganismes
-
Les très faibles nombres, en particulier de spores, dont la probabilité
de germination est faible et variable.
Ainsi, pour
tenter d’éviter ces écueils, l’utilisateur d‘un modèle devrait
d’abord le valider sur son produit et son process ou considérer que la prévision
n’est qu’une première estimation qu’il faut confirmer par des expérimentations
directes.
3
– Perspectives :
Dans les années
qui viennent, la prévision de la durée de conservation, de la sécurité et de
la qualité à partir des modèles, se développera à mesure que l’accès aux
bases des modèles sera rendu plus aisé et que les modèles seront validés
plus largement au niveau international.
Ainsi, même si
l’accès à ces modèles deviendra plus facile, il faut rester très prudent
car ils ne représentent que partiellement la réalité. En somme, il ne faut
surtout pas considérer ces modèles comme des oracles, il s’agit plutôt de
les utiliser comme des systèmes d’aide à la décision.
Par ailleurs,
différents travaux cherchent à croiser les données issues de la microbiologie
prévisionnelle avec d’autres disciplines comme la mécanique des fluides.
Ceci permettrait notamment de déterminer des flux, de savoir comment les bactéries
sont distribuées… Cette voie est sans doute l’une de celles qui permettront
dans l’avenir de s’approcher de l’idéal de l’usine ultra propre.
De toute façon,
une grande prudence est de rigueur lorsqu’il s’agit de prévoir le
comportement des bactéries dangereuses comme Listeria ou Salmonella.