
Détermination
de l'enthalpie molaire standard de combustion du méthanol CH3OH à
338 K connaissant son enthalpie molaire
standard de combustion à 298 K.
Données :
| CH3OH (l) | O2 (g) |
|
H2O (l) | |
| DcH° (CH3OH, l, 298 K) (kJ mol-1) | - 726,7 | |||
| CP (J mol-1 K-1) | 81,1 | 30 | 44,2 | 75,2 |
| Lvap (kJ mol-1) | 35,2 | |||
| Tvap (K) | 338 |
Remarque : 338 K est la température de vaporisation du méthanol. On peut donc envisager à cette température :
soit la combustion du méthanol à l'état gazeux
On peut utiliser le cycle thermodynamique suivant :

mais on peut aussi appliquer directement la loi de KIRCHOFF :
DcH° (CH3OH, l, 338 K) =
DcH° (CH3OH, l, 298 K) + Sn i.CP.(338 - 298)
(les CP étant constants)
A.N. :
DcH° (CH3OH, l, 298 K) =
- 726,7 + (44,2 + 2.75,2 - 81,1 - 3/2.30).10-3.40
=
- 726,7 + 2,74
DcH° (CH3OH, l, 338 K) = - 723,96 kJ mol-1
Dans ce cas, l'utilisation du cycle thermodynamique est indispensable pour faire apparaître le changement d'état physique du méthanol :
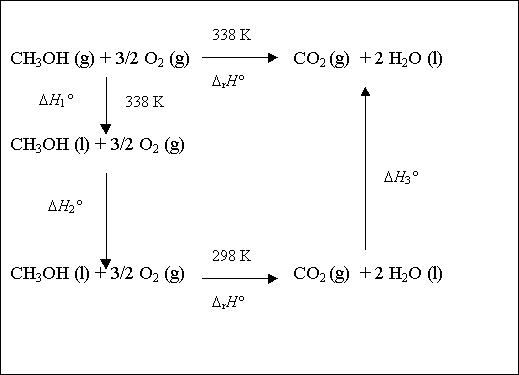
ce qui permet d'écrire :
DrH°(CH3OH, g, 338 K) =
DH°1 + DH°2 + DrH°(CH3OH, l, 298 K) + DH°3
DH°2 et DH°3 représentent les variations d'enthalpie dues aux changements de température des réactifs et des produits
DH°1 représente le changement d'état physique du méthanol à température constante (338 K) :
DH°1 = - Lvap(CH3OH, l).
A.N.
DcH° ( CH3OH, g, 338 K)
=
DcH° ( CH3OH, l, 298 K) + Sni.CP.(338 - 298) - Lvap( CH3OH)
=
- 726,7 + 2,74 - 35,2
DcH° (CH3OH, g, 338 K) = - 759,16 kJ mol-1
Remarque
Par rapport à la combustion à 298 K :
DcH° (CH3OH, l, 298 K) = - 726,7 kJ mol-1
on constate que
lorsqu'il n'existe aucun changement d'état physique DcH° varie peu (0,4 %)
cette variation est plus importante lorsque le méthanol a changé d'état physique (4,5 %)