I.3 - Grandeurs de réactions
I.3.1 - Enthalpie molaire standard de réaction
- Définition.
On appelle enthalpie molaire standard de réaction la variation d'enthalpie associée à toute réaction chimique pour un avancement x = 1 mol. Elle est représentée par la grandeur :
Elle s'exprime
en J mol-1.
- Exemple.
Remarque importante.
En faisant réagir des quantités de matière égales aux coefficients stoechiométriques, on réalise les conditions d'avancement x = 1 mol.
- Démonstration :
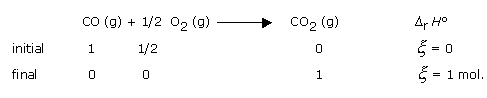
En thermochimie, on définit aussi des réactions spécifiques et leurs grandeurs associées.
I.3.2 - Enthalpie molaire standard de formation
- Définition.
C'est la variation d'enthalpie standard associée à la réaction de formation de 1 mole d'un composé à partir de ses éléments pris dans leur état standard, et dans leur état physique le plus stable.
Elle est représentée par la grandeur :
Elle s'exprime en J mol-1.
- Exemple :
DfH° (CO, g, 298 K)
CO (g) est formé des 2 éléments C et O. Leur état physique le plus stable à 298 K est :
- C : carbone à l'état solide C (s)
- O : dioxygène à l'état gazeux O2 (g)
DfH° (CO, g, 298 K) est donc la variation de H° associée à la réaction :
Remarque :
- Lorsqu'un élément existe sous plusieurs états d'agrégation, il est nécessaire de préciser l'état d'agrégation le plus stable.
Exemple : état physique le plus stable de C (s) à 298 K : le carbone solide sous forme graphite C (s, graphite)
- L'état physique le plus stable dépend de la température.Exemple :
- à 298 K, le dibrome est à l'état liquide Br2 (l)
- à 1900 K, le dibrome est à l'état gazeux Br2 (g)
Autres exemples : (HypN)
- Conséquence.
DfH° de tout élément pris dans son état standard et dans son état physique le plus stable est égale à 0 puisque d'après la définition cet élément est à la fois l'origine et l'aboutissement de cette variation.
Exemples :
A T = 298 K, l'oxygène est gazeux, le carbone est solide et son état d'agrégation le plus stable est le graphite, donc :
DfH° (Cgraphite, s) = 0
alors que :
DfH° (Cdiamant, s)
I.3.3 - Enthalpie molaire standard de dissociation de liaisons covalentes
- Définition.
C'est la variation d'enthalpie standard associée à la rupture de la liaison entre deux atomes dans 1 mole à l'état gazeux pour former les atomes isolés supposés à l'état gazeux.
Elle est représentée par la grandeur :
Elle est aussi appelée énergie de liaison ou énergie d'atomisation.
- Exemple.
DH-ClH° est la variation d'enthalpie associée à la réaction :
- Energie réticulaire.
C'est une aute enthalpie molaire standard qui s'adresse à des composés ioniques. (HypN).
I.3.4 - Autres réactions
I.3.5 - Energie interne molaire standard
I.3.6 - Remarque importante sur les grandeurs de réaction et les équations bilans associées